В предыдущих двух выпусках мы поделились соответствующими исследованиями по использованию дигидрата D(+)-трегалозы для криоконсервации клеток-предшественников олигодендроцитов человека (OPCs) и стволовых клеток жирового происхождения (ADSC). Те исследования нашли что добавление некоторого количества двугидрата д (+)-треалосе к криоконсервации средству или использование составного криопротектант двугидрата + глицерола д (+)-треалосе смогло улучшить тариф спасения стволовых клеток после долгосрочного криоконсервации, таким образом способствуя последующему клиническому применению стволовых клеток для лечения заболеваний или заживления ран.
В этом выпуске мы берем криоконсервацию зародышевых клеток яичек мыши в качестве примера для изучения перспектив применения дигидрата D(+)-трегалозы в области вспомогательной репродукции.
Влияние различных криопротекторов на криоконсервацию зародышевых клеток яичек у незрелых мышей
В последние годы, с быстрым развитием вспомогательных репродуктивных технологий, стало возможным все больше и больше бесплодных мужчин рожать потомство. В этом процессе долгосрочная криоконсервация клеток, связанных с репродукцией, стала одной из ключевых технических трудностей, влияющих на вероятность успеха.
Например, для препубертатных пациентов мужского пола с раком лечение гонадной токсичностью может привести к постоянной потере фертильности, а длительная криоконсервация ткани или клеток яичка при низких температурах является важным средством сохранения их фертильности.
Однако для пациентов с системными опухолями аутологичная трансплантация криоконсервированной ткани яичка после размораживания представляет риск повторного введения раковых клеток. Учитывая, что раковые клетки могут быть выделены из суспензии клеток яичек, а сперматогониальные стволовые клетки (SSC) можно культивировать in vitro, чтобы индуцировать дифференцировку в круглые сперматиды, рождение потомства может быть достигнуто путем круглой инъекции сперматиды.
Таким образом, для препубертатных пациентов мужского пола с раком длительная криоконсервация половых клеток яичек является одним из ключевых способов сохранения мужской фертильности и имеет потенциальную ценность для клинического применения.
Чжан Сяолун из Народной больницы провинции Хэнань и другие исследователи использовали двухнедельных мышей для моделирования состояния развития незрелой тестикулярной ткани человека до полового созревания и приняли различные протоколы криоконсервации для криоконсервации зародышевых клеток яичек мыши, чтобы исследовать лучший метод криоконсервации.
В исследовании криоконсервационные среды были разделены на следующие 5 групп в соответствии с различными компонентами:
Группа | Криоконсервация Средний состав |
А | Среда DMEM/F12, содержащая 10% ДМСО + 10% FBS |
В | ДМЕМ/F12 среда, содержащая 10% ДМСО + 10% FBS + 0,1 моль/л сахарозы |
С | ДМЕМ/F12 среда, содержащая 10% ДМСО + 10% FBS + 0,1 моль/л D(+)-трегалозы дигидрат |
Д | Среда DMEM/F12, содержащая 15% ДМСО + 10% FBS + 0,1 моль/л сахарозы + 0,1 моль/л D(+)-трегалозы дигидрат |
Е | ДМЕМ/F12 среда, содержащая 10% ДМСО + 10% FBS + 0,1 моль/л сахароза + 0,1 моль/л D(+)-трегалозы дигидрат |
Контроль | Половые клетки яичка, диссоциированные из свежей ткани яичка мыши (без криоконсервационной среды) |
Суспензию зародышевых клеток яичек мыши получали двухэтапным ферментативным гидролизом, распределяли и переносили в криогенные флаконы после добавления каждого из пяти различных криопротекторов соответственно. Криогенные флаконы подвергались запрограммированному замораживанию, вынимались из резервуара с жидким азотом через 2 месяца и восстанавливались для определения выживаемости клеток, скорости апоптоза и потенциала митохондриальной мембраны.
① Выживаемость клеток и скорость восстановления до и после криоконсервации
По сравнению с тем, что было до криоконсервации, выживаемость клеток после криоконсервации снизилась во всех пяти тестовых группах. Среди них выживаемость клеток и скорость восстановления в группе Е были значительно выше, чем в других четырех тестовых группах.
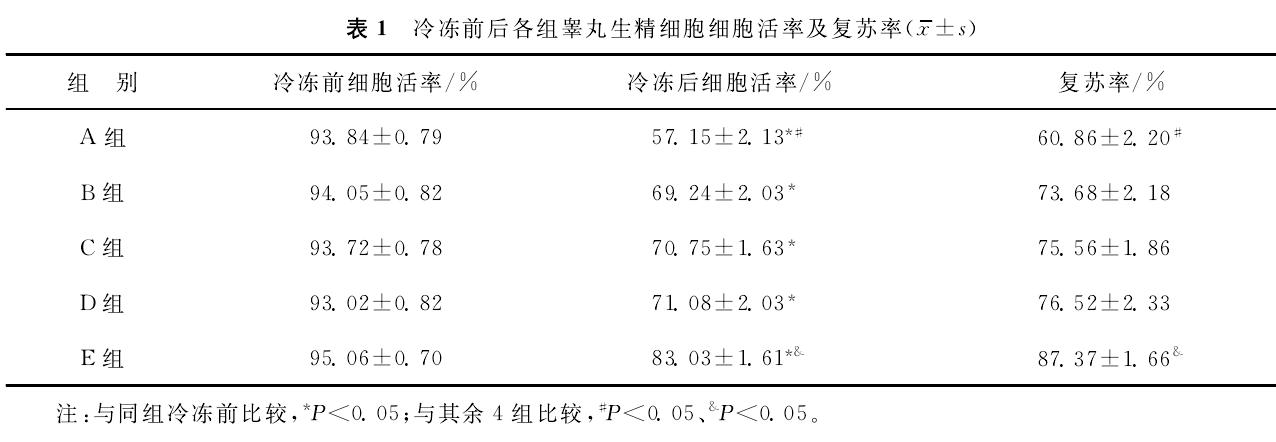
② Восстановление клеток после криоконсервации
В каждой группе скорость восстановления половых клеток яичек после криоконсервации количественно оценивали на основе количества жизнеспособных клеток, фактически восстановленных из 4 мг диссоциированной и криоконсервированной ткани яичка после размораживания. Результаты показали, что количество клеток, восстановленных в группе Е, было значительно выше, чем в других четырех тестовых группах.
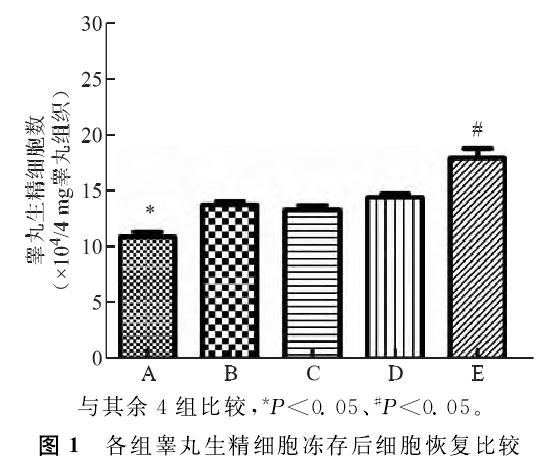
③ Скорость апоптоза
Скорость апоптоза была обнаружена с помощью проточной цитометрии (ФК) в каждой группе. Результаты показали, что скорость апоптоза была значительно увеличена в каждой тестовой группе по сравнению с контрольной группой. В пяти тестовых группах частота апоптоза в группе Е была значительно ниже, чем в других четырех тестовых группах.
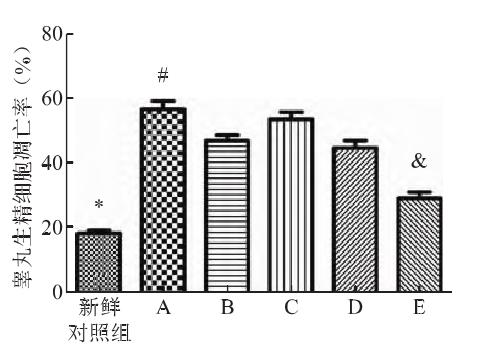
④ Потенциал митохондриальной мембраны
По сравнению с контрольной группой митохондриальный мембранный потенциал криоконсервированных клеток значительно снизился после оттаивания в пяти испытуемых группах, при этом наименьшее снижение в группе Е было значительно ниже, чем в других четырех испытуемых группах.
Криопротекторы могут быть классифицированы как проницаемые и непроницаемые. Наиболее часто используемыми непроницаемыми криопротектами являются сахароза и D(+)-трегалозный дигидрат. Предыдущие исследования подтвердили, что добавление сахарозы или дигидрата D(+)-трегалозы к криопротекторам может значительно увеличить скорость восстановления зародышевых клеток яичек у макак-резусов или мышей.
Результаты вышеуказанного исследования показали что добавление 0,1 мол/Л сахарозы или 0,1 мол/Л д (+)-двугидрата трегалозы к криопротектант имело некоторое защитное влияние на криоконсервации клетки, пока добавляя 0,1 мол/Л сахарозу и 0,1 мол/Л д (+)-двугидрат треалосе в то же время значительно увеличил тариф спасения крйоконсервированных половых клеток мыши тестикулярных после таять, Уменьшил тариф апоптоз, и уменьшил повреждение к митохондриальному потенциалу мембраны причиненному криоконсервацией.
Однако цитотоксичность, вызванная более высокой концентрацией ДМСО (15%), частично компенсирует криопротекторный эффект сахарозы и дигидрата D(+)-трегалозы.