Фосфолипиды и холестерин являются важными компонентами клеточной мембраны. Они играют важную роль в трансмембранном транспорте клеток, передаче сигналов и биологическом метаболизме. Но каковы же их взаимодействия? В этом обзоре литературы мы поделимся статьей об анализе взаимодействий между фосфолипидами и холестерином (CHOL) с использованием двух средств: рассеяния и моделирования молекулярной динамики. Есть надежда, что это не только улучшит наше понимание структуры клеточной мембраны, но и принесет вдохновение в развитие липосом и липидных наночастиц.
 Аннотация:
Аннотация:
Холестерин и фосфолипиды повсеместно присутствуют в клеточных мембранах млекопитающих, и их взаимодействие имеет решающее значение для липид-опосредованного оборота холестерина. Взаимодействие между холестерином и фосфолипидами было определено путем объединения малоугольного нейтронного рассеяния (SANS), малоугольного рентгеновского рассеяния (SAXS) и моделирования молекулярной динамики (MD) всего атома.
Моделирование: Построена модель распределения плотности рассеяния двухслойных, состоящих из холестерина и эфирных липидов, и получены структурные параметры различных двухслойных мембран.
Моделирование: Моделирование молекулярной динамики с ограничениями площади поверхности было выполнено, и экспериментальные данные были воспроизведены. Этот итеративный аналитический подход дал хорошее согласие между экспериментальными и моделируемыми структурами, а молекулярные взаимодействия между холестерином и фосфолипидами были дополнительно проверены с помощью моделирования MD.
Заключение: · В присутствии эфирного липида гидроксильная группа (-ОН) холестерина в основном образует водородные связи с фосфатной группой на головке фосфолипида. В присутствии фосфолипидов гидроксильная группа холестерина образует водородные связи с карбонильной группой на фосфолипидной жировой цепи. Таким образом, холестерин перемещается ближе к двухслойной поверхности, когда присутствуют эфирные липиды, и вызывает обезвоживание фосфатных групп в голове. Кроме того, трехмерное пространственное распределение плотности вокруг холестерина предполагает, что он подвергается анизотропной цепной упаковке, что приводит к наклону холестерина.
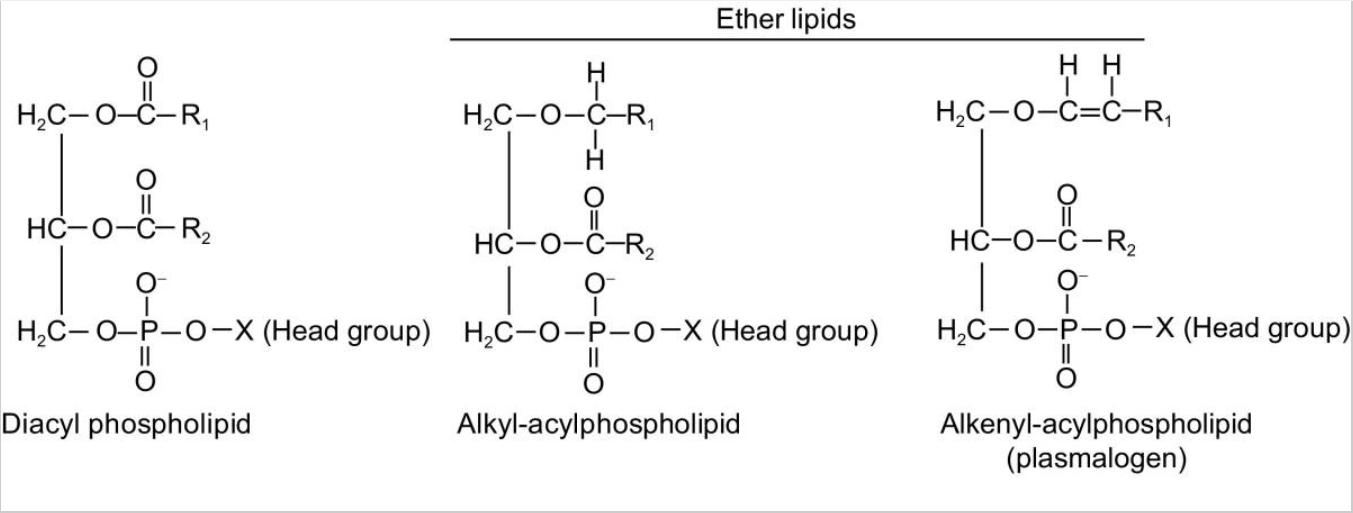
Рис. 1. Молекулярная структура фосфолипидов и эфирных липидов
Материал:
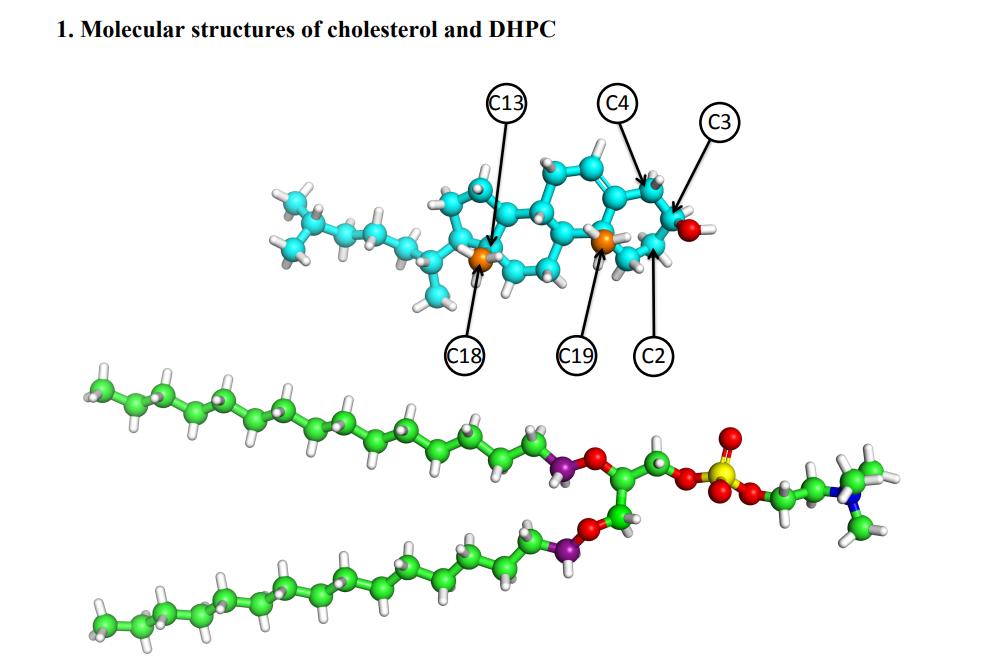
Рис. 2. Молекулярные структуры холестерина (CHOL) и дигексадецилфосфатидилхолина (DHPC)
Построенная модель представляет собой липидный двухслойный слой, состоящий из холестерина (CHOL) и дигексадецилфосфатидилхолина (DHPC). Атомные изображения модели распределения плотности рассеяния (SDP) сначала были получены методом моделирования MD без применения поверхностного натяжения, затем были определены различные структурные параметры (площадь липида, толщина двухслойного гидрофобного слоя и т. д.), а затем модель была оптимизирована путем анализа экспериментальных данных. Моделирование MD проводили по поверхностному натяжению на более поздней стадии, а молекулярные взаимодействия между холестерином и различными липидами дополнительно анализировали путем сравнения результатов моделирования с результатами испытаний.
Малоугольное рассеяние нейтронов (SANS):
Нейтронное тестирование проводилось с использованием рассеянного источника нейтронов (SNS) BL-6 EQ-SANS в Национальной лаборатории Ок-Ридж. Вектор полного рассеяния Q (0,03 <Q <0,8 Å-1) Был рассчитан с использованием детектора в диапазоне waДлины (2,5-6,0 Å), с расстоянием от детектора до образца 2,0 м. С помощью программного обеспечения, предоставленного SNS для коррекции и шумоподавления, путем анализа данных были получены одномерные (1D) интенсивности.
Малоугольное рассеяние рентгеновских лучей (SAXS):
Рентгеновские данные были собраны из источника синхротронов высокой энергии Корнелла G-1. Зарядный ответвитель FLICAM (линейный размер 71 мкм, массив пикселей 1024 МИ 1024) использовался для обнаружения рассеяния от коллимированного падающего луча (0,24 МИ 0,24 мм).2), Освещенные рентгеновскими лучами на длине волны 1,17 Å на образцах ULV. Расстояние от образца до детектора было 505,8 мм. Образец был перенесен в 1,5-мм кварцевую капиллярную трубку и помещен в стойку с регулируемой температурой. Взаимосвязь между интенсивностью рассеяния I и вектором рассеяния Q была получена путем вычитания радиального усреднения по фону двумерных (2D) данных. Затем он преобразуется в форм-фактор рентгеновского излучения, используя ту же зависимость, что и нейтроны.
Моделирование молекулярной динамики (MD):
CHARMM-GUI Membrane Builder использовался для генерации координат для чистого двухслойного DHPC (128 DHPC) и двухслойного DHPC с 20 моль % холестерина (128 DHPC + 32CHOL).
Поскольку эфирный липид DHPC не был включен в отбор липидов CHARMM-GUI, необходимо было сначала построить двухслойную модель DPPC с использованием CHARMM-GUI, а затем изменить карбонильную группу (C = O) в DPPC на метиленовую группу (CH2) В DHPC. Систему растворяли путем добавления 4300-4800 молекул воды, в то время как вводили достаточное количество NaCl для баланса заряда. Пакет NAMD (версия 2,816) и липидное силовое поле CHARMM 36 были использованы для моделирования MD. Для конкретной оптимизации силового поля и настроек параметров MD см. исходный текст, а также вспомогательные документы.
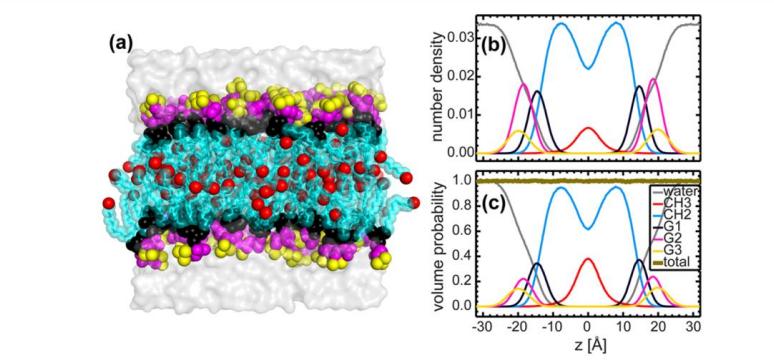
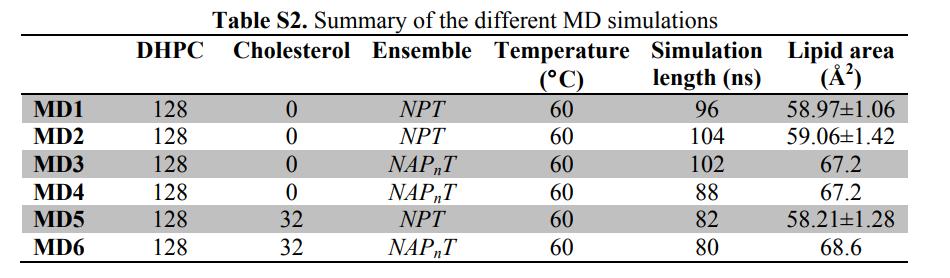
Рис. 3. Система моделирования MD и конструкция двухслойной системы DHPC
А) уравновешенные двухслойные системы, в которых липидный двухслойный слой разделяется на пять компонентов (цветовая дифференциация): красно-метил (СН3); Черный глицериновый остов + эфирная связь; светло-синий-метилен (CH2); Пурпурная головная группа (фосфатный радикал + CH2СН2N); и желто-холиновый концевой триметил.
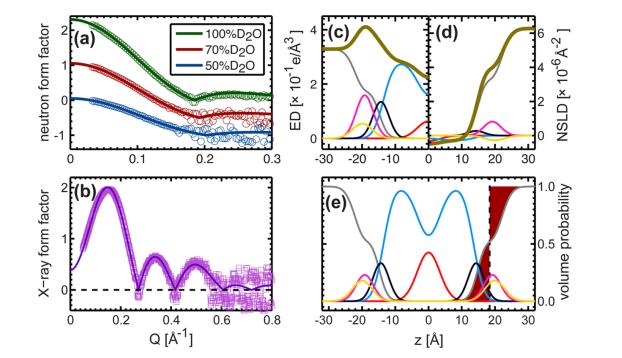
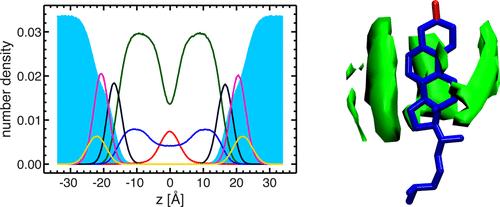
Рис. 4. Выяснение моделей SDP различными сравнительными экспериментальными факторами
(Липидный состав описывается аналитическими функциями (т. е., Гауссова функция и функция ошибки), а содержание воды определяется дополнением с полным интегралом липосомы. A: рассеяние нейтронов; b: рассеяние рентгеновских лучей; c: общая электронная плотность; d: длинная плотность рассеяния нейтронов; e: объемное распределение. Примечание: описание цвета соответствует рис. 3)
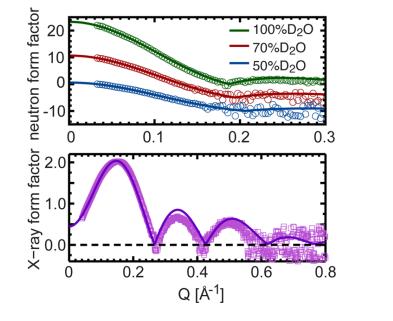
Рис. 4. Прямое сравнение форм-факторов нейтронного и рентгеновского излучения для различных экспериментов по контрасту
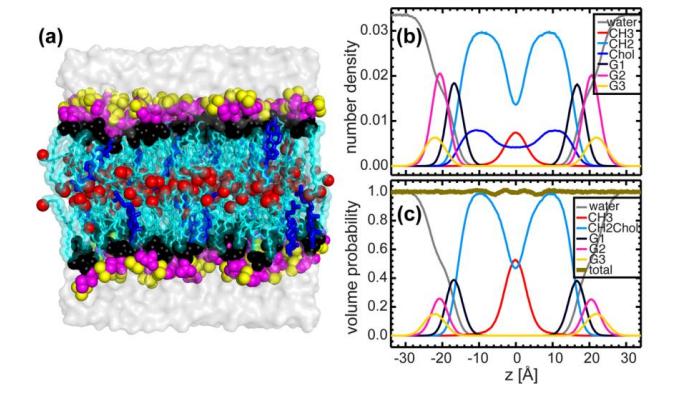
Рис. 5. МД моделирование двухслойного, содержащего 20 моль % холестерина и DHPC
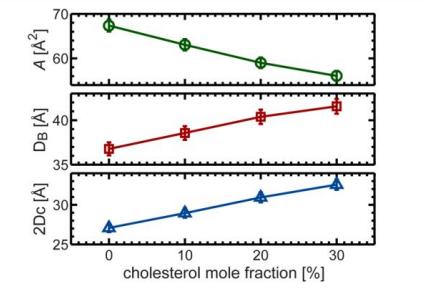
Рис. 6. Концентрация холестерина в сравнении с изменениями репрезентативных структурных параметров для двухслойных DHPC
(Эффект упорядочения холестерина демонстрируется уменьшением площади поверхностных липидов с увеличением концентрации холестерина, увеличением толщины двухслойной липидной мембраны D.ВИ толщина углеводорода 2DС, И приблизительно линейное изменение в влиянии агрегирования холестерола.)
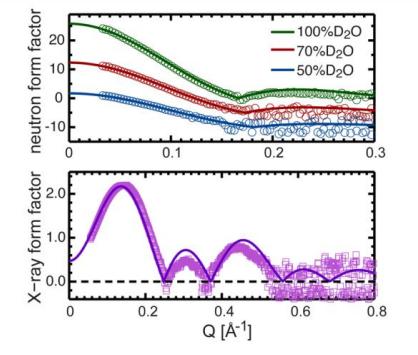
Рис. 7. Прямое сравнение различных экспериментальных форм-факторов для двухслойных мембран DHPC, состоящих из 20 моль % холестерина, и форм-факторов, рассчитанных методом NAPnT Kinetic Simulation на фиксированной единичной клеточной площади
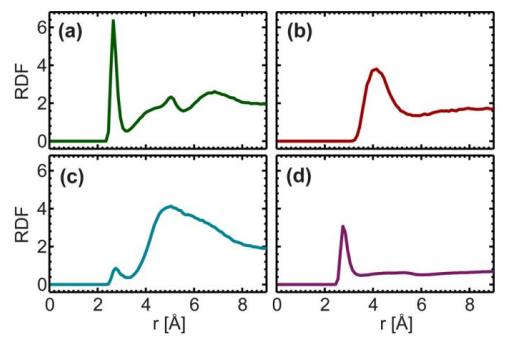
Рис. 8. Радиальная функция распределения гидроксильной группы (-OH) холестерина с фосфатным радикалом (a), атома N холина (b), эфирной группы основной цепи (-O-, c) и атома кислорода в свободной воде (резкий пик наблюдался для фосфатного радикала и воды при 2,7 Å, И широкий пик наблюдался для атома N в холине при 4 Å.)
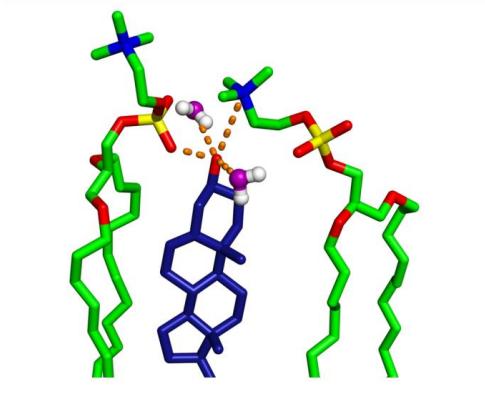
Рис. 9. Водородная связь между CHOL-OH и близлежащими липидами на основе распределения RDF на Рис. 8. (Оранжевый указывает на потенциальные водородные связи и электростатические взаимодействия.)
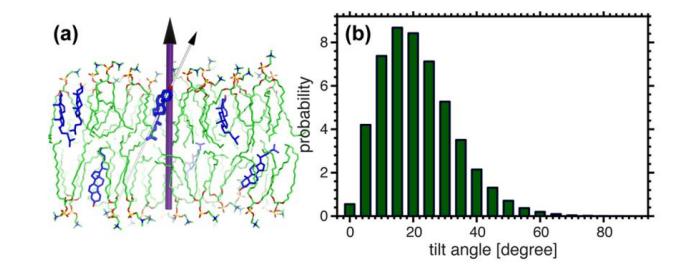
Рис. 10. Наклон плоского тетралопа холестерина относительно нормы бислоя. Холестерин распределяется в мембране не вертикально, а под определенным углом. Подавляющее большинство холестерина имеет распределение наклона 20 °.
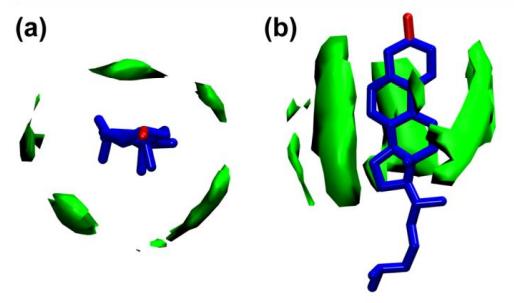
Рис. 11. 3D распределение плотности алифатических углеводородных цепей вблизи холестерина. Анизотропная упаковка цепи связана с тетралопсом холестерина, а упаковка цепи высокой плотности также происходит вблизи гладкой поверхности кольца.
Заключение:
Это исследование сочетало эксперименты с моделированием. SANS и SAXS использовались для исследования молекулярного положения и ориентации холестерина в бислоях эфирных липидов. Причины различных свойств рассеяния бислоев были дополнительно проанализированы с помощью моделирования MD, которое легло в основу модели SDP для анализа экспериментальных данных. Напротив, параметры модели были дополнительно оптимизированы с использованием структурных параметров, полученных экспериментально, для повышения достоверности и надежности моделирования MD и определения молекулярных взаимодействий между холестерином и эфирными липидами. Молекулярные взаимодействия между обычными ацилфосфолипидами и холестерином-совсем другое.
Конкретно:
В двухслоях, состоящих из эфирных липидов, гидроксильная группа (-OH) на холестерине образует водородные связи с кислородом в фосфатных группах, в то время как в обычных фосфолипидах гидроксильные группы имеют тенденцию образовывать водородные связи с карбониальными группами (C = O) на фосфолипидных жирах из-Наличие сложноэфирных групп. Это различие во взаимодействиях может объяснить важную роль, которую ацетальные фосфолипиды (эфирные липиды) играют в посредничестве транспорта холестерина. Что еще более важно, в настоящем исследовании взаимодействия между различными молекулами в мембранной среде дополнительно модулировались путем изменения химического состава липидов.
Холестерин, включаяХолестерин HP, Играет большую роль в организмах и также важный фармацевтический екссипиент. АВТ поставляет растительный холестерин. Свяжитесь с нами для получения дополнительной информации.
Ссылки:
[1]. Дин ДМ, Лодхи И Джей.Структурные и функциональные роли эфирных липидов.Клетка протеина. 2018;9(2):196-206. дой: 10,1007/s13238-017-0423-5
[2]. Пан Й, Ченг Х, Хеберле ФА, Мостофян Б, Кучерка Н, Дразба П, Кацарас Й. Взаимодействие между эфирными фосфолипидами и холестерином определяется путем моделирования рассеяния и молекулярной динамики. Дж Фис Хем Б. 2012 27 декабря; 116(51):14829-38. Doi: 10,1021/jp310345j. EPUB 2012 Декабрь 13. PMID: 23199292; PMCID: PMC3539752.